 |
| ИНФОРМАЦИЯ
| |||||||||||||||||||
Сравнение двух тест-систем для количественного определения РНК ВИЧ в плазме крови "Cobas Amplicor HIV-1 Monitor v. 1.5" и "LCx HIV RNA Quantitative assay" в процессе клинических испытанийС использованием образцов крови от Российских пациентов, инфицированных ВИЧБогословская Е. В., Цыганова Г. М., Башкирова Л. Ю., Шипулин Г. А., Орехов В. // Сравнение двух Центральный НИИ эпидемиологии МЗ РФ, Москва; 2 Эбботт лабориториз С. А., Москва В соответствии с современными требованиями определение концентрации РНК вируса иммунодефицита человека (ВИЧ) в плазме крови («вирусной нагрузки») является обязательной процедурой, начиная с момента постановки диагноза Недавно разработанная фирмой «Эбботт» (Швейцария)
Целью настоящей работы являлось проведение расширенных клинических испытаний Материалы и методыПациенты. В работе были исследованы образцы цельной крови, полученные в 2003 году от 207 Таблица 2. Панель субтипов ВИЧ-1
Забор крови и подготовка ее к анализу. Кровь забирали утром натощак в пробирку Определение концентрации РНК ВИЧ. Концентрацию РНК ВИЧ определяли согласно прилагаемым 1. Тест-система "Cobas Amplicor 2. Тест-система "LCx HIV RNA Quantitative assay". Линейный диапазон измерения концентрации РНК ВИЧ от 178 до 5.000.000 копий РНК/мл. РНК выделяли из 100 мкл плазмы крови путем хроматографического разделения нуклеиновых кислот с помощью колонок производства QIAGEN (Германия). Очищенную РНК элюировали в 120 мкл и 50 мкл добавляли в амплификационную смесь. Амплификацию проводили на амплификаторе LCx Thermal Cycler («Эбботт», США). Детекцию продуктов ПЦР осуществляли автоматически, используя анализатор LCx («Эбботт», США). Степень совпадения количественных результатов. Для оценки сопоставимости количественных результатов было протестировано 207 образцов плазмы крови Определение субтипа ВИЧ в образцах крови Российских пациентов. Определение субтипа ВИЧ осуществляли, используя РНК вируса, выделенную из плазмы крови. Те образцы, в которых концентрация РНК была ниже 1000 копий/мл, типировали, используя провирусную ДНК, выделенную из лейкоцитов крови. ДНК или кДНК амплифицировали в формате РезультатыКорреляция результатов. Выявлена высокая степень корреляции результатов измерения концентрации РНК ВИЧ, полученных с помощью Таблица 3. Распределение образцов в зависимости от разницы между результатами измерения вирусной нагрузки, полученными с помощью |
| Разница логарифмов концентрации РНК ВИЧ (LCx – Cobas Amplicor) | Количество образцов/% |
|---|---|
| от 0,51 до 1 lg | 3/1,3 |
| В пределах 0,5 lg | 209/87,1 |
| 28/11,7 |
Рисунок 1. Корреляция результатов измерения вирусной нагрузки с помощью тест-систем "Cobas Amplicor HIV-1 Monitor v. 1.5" и "LCx HIV RNA Quantitative assay"
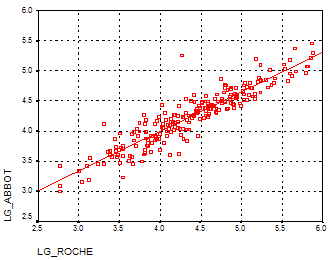
Высокая степень совпадения результатов была выявлена при тестировании образцов плазмы крови от Российских
При тестировании образцов с охарактеризованным субтипом из панели, предоставленной фирмой «Эбботт», было выявлено большее количество дискордантных результатов (24%) по сравнению с панелью Российских образцов. Как видно из таблицы 4, дискордантные результаты наблюдались, в основном, в образцах, содержащих ВИЧ субтипов G (67%), A (50%) и C (50%).
Таблица 4. Отличия между результатами вирусной нагрузки, полученными с помощью двух тест-систем на панели образцов, содержащих ВИЧ разных субтипов
| Субтипы ВИЧ, представленные в панели | Разница логарифмов концентрации РНК ВИЧ |
|---|---|
| D | 0,18 |
| D | 0,11 |
| D | 0,34 |
| D | 0,31 |
| D | 0,34 |
| D | 0,14 |
| G | 0,16 |
| G | 0,66 |
| G | 0,82 |
| F | 0,32 |
| F | 0,30 |
| F | 0,08 |
| F | 0,00 |
| F | 0,51 |
| F2 | 0,28 |
| A | 0,52 |
| A | 0,16 |
| A | 0,75 |
| A | 0,54 |
| A | 0,33 |
| A | 0,22 |
| CRF01_AE | 0,22 |
| CRF01_AE | 0,25 |
| CRF01_AE | 0,39 |
| CRF01_AE | 0,65 |
| CRF01_AE | 0,11 |
| CRF02_AG | 0,19 |
| CRF02_AG | 0,25 |
| CRF02_AG | 0,45 |
| C | 0,35 |
| C | 0,64 |
| C | 0,05 |
| C | 0,83 |
| C | > 0,63 |
| C | 0,53 |
| C | 0,42 |
| C | 0,09 |
| B | 0,06 |
| B | 0,20 |
| B | 0,04 |
| B | 0,08 |
| B | 0,01 |
| Mosaic | 0,46 |
| Mosaic | 0,63 |
| Mosaic | 0,28 |
| Mosaic | 0,38 |
В процессе испытаний было выявлено 17 образцов плазмы крови (8,2%) вне линейного диапазона
Типирование образцов от Российских пациентов показало, что наиболее распространенным субтипом ВИЧ в России является субтип А (93%) и в небольшом количестве присутствуют субтипы В (5%), G (1,5%) и С (0,5%). Все дискордантные результаты были получены на образцах, содержащих ВИЧ субтипа А. Причем, в 95,5% случаев результат, полученный с помощью
Обсуждение
Тест-система «LCx HIV RNA Quantitative assay», предназначенная для количественного определения РНК ВИЧ, была не однократно исследована в клинических испытаниях по сравнению
Поскольку в России доминирует ВИЧ субтипа А, а также распространены и другие субтипы
В настоящей работе было проведено исследование 207 образцов плазмы крови
При тестировании образцов с помощью
Показатели вирусной нагрузки, полученные в процессе исследования Российских пациентов, в большинстве случаев укладывались в линейный диапазон изучаемых
Тест-система "LCx HIV RNA Quantitative assay" оказалась достаточно простой в использовании: стадии выделения РНК и детекции продуктов ПЦР автоматизированы. Детекция продуктов амплификации осуществляется с помощью автоматического анализатора LCx фирмы «Эбботт», который не требует сложного программирования по сравнению с аналогичным анализатором Cobas Amplicor фирмы
Выводы
- Выявлена высокая степень корреляции результатов, полученных с помощью двух
тест-систем "LCx HIV RNA quantitative assay" и "Cobas AmplicorHIV-1 Monitor v. 1.5 Assay". - В 87% случаев отличия между результатами находились в пределах 0,5 lg.
- Тест-система "LCx HIV RNA Quantitative assay" обладает большим диапазоном измерения концентрации РНК ВИЧ, чем
тест-система "Cobas AmplicorHIV-1 Monitor v. 1.5". - На основании полученных результатов
тест-систему "LCx HIV RNA quantitative assay" можно рекомендовать к регистрации и использованию на территории РФ.
Литература
- P. Swanson, V. Soriano, S. G. Devare, J. Hackett. Comparative performance of three viral load assays on Human Immunodeficiency Virus Type 1
(HIV-1) isolates representing group M (subtypes A to G) and group O: LCx HIV RNA Quantitative, AmplicorHIV-1 Monitor Version 1.5, and QuantiplexHIV-1 RNA Version 3.0. J. Clin. Microbiol. 2001. Vol. 39, №3,p. 862-870. - Troonen H., Grey H., Michel G. Multicenter study of the LCx HIV RNA quantitative assay — a new competitive reverse
transcriptase-PCR which targets pol genomic regionof HIV-1 for the measurement of type B,non-type B and group OHIV-1 RNA. Clin. Chem. Lab. Med. 2002. 40(7):698-704. - Plantier J. C., Gueudin M., Damond F. et al. Plasma RNA quantification and
HIV-1 divergent strains. J. Acquir. Immune Defic. Syndr. 2003, 1; 33(1):1-7. - C. de Mendoza, J. Alcami, M. Sainz et al. Evaluation of the Abbott LCx Quantitative assay for measurement of Human Immunodeficiency Virus RNA in plasma. J. Clin. Microbiol. 2002. Vol. 40, №4,
p. 1518-1821. - А. Ф. Бобков, Е. В. Казеннова, М. Р. Бобкова и др. //
Молекулярно-генетическая характеристикаВИЧ-1 на территории России. // Вестник Российской Академии медицинских наук. 2002, №8.
Публикации
Новости
- 15 июля 2015
Новое клиническое исследование для пациентов с отсутствием вирусологической эффективности терапии ВИЧ-инфекции - 23 июня 2015
Приглашаем принять участие в эпидемиологическом исследовании для женщин - 04 апреля 2015
НАЦИОНАЛЬНЫЕ РЕКОМЕНДАЦИИ ПО ДИСПАНСЕРНОМУ НАБЛЮДЕНИЮ И ЛЕЧЕНИЮ БОЛЬНЫХ ВИЧ-ИНФЕКЦИЕЙ (проект, версия 2015г.)" - 12 марта 2015
Справка "ВИЧ-инфекция в Российской Федерации на 31 декабря 2014 г." - 03 марта 2015
Протокол Организационного комитета Пятой Конференции по вопросам ВИЧ/СПИДа в Восточной Европе и Центральной Азии - 02 марта 2015
Совещание Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, г. Суздаль
10-13 марта 2015г. - 08 февраля 2015
Регистрация на сайте(важно!)
| © 2007-2026, Федеральный | ||
